产品介绍
器械法规(MDR)的背景
MDR将取代现有的器械指令(93/42/EEC)(MDD)和主动植入式器械指令(90/385/EEC) (AIMDD)。MDR于2017年5月发布,标志着MDD和AIMDD之间为期三年的过渡期的开始。
在过渡期间,MDR将逐步生效,首先是与公告机构和制造商根据MDR申请新证的能力有关的规定。
过渡期将于2020年5月26日,即MDR法规的“适用日期”(DoA)结束。从那时起,MDR将完全适用。
目前急需做CE认证的客户很多,检测认证公司,代理公司也是鱼目混
杂,参差不齐。
怎么辨别口罩CE认证的真假呢?
1,凡是说3、5两千可以出CE证的都是
2,凡是说3/2天可以*的都是
3,凡是说国内公司自己可以发CE证的都是
辨别证的真伪很重要,因为一旦货到了港口清不了关损失就大了。
所以不要贪图*和快而上当受
NB号的CE证。按照现行的欧盟器械法规,此路径获取CE证的
时间至少8个月以上,费用比较昂贵。
欧盟I类器械,如果是非灭菌产品,具体分类为I类。按照指令要求,
公告机构不可强制介入I类器械的发证事宜,制造商可以基于完整的CE技
术文档宣称符合CE(自我CE符合性声明格式如下)。也即,制造商不需
要找发证机构去申请带NB号的CE证,制造商根据自己出具自我CE符
合性声即可打上CE mark,出口欧盟。在欧盟有经销活动前,需要委托
欧盟授权代表去当地主管机构做欧盟注册,整个欧盟28个成员国,只需
登记一次。整个周期是1-4周。
我司可以办理:
1:欧盟MDR CE,欧盟授权代表,欧盟注册
2:美国FDA注册,FDA510K
3:国内的器械注册证和生产许可证
4:加拿大的MDEL注册
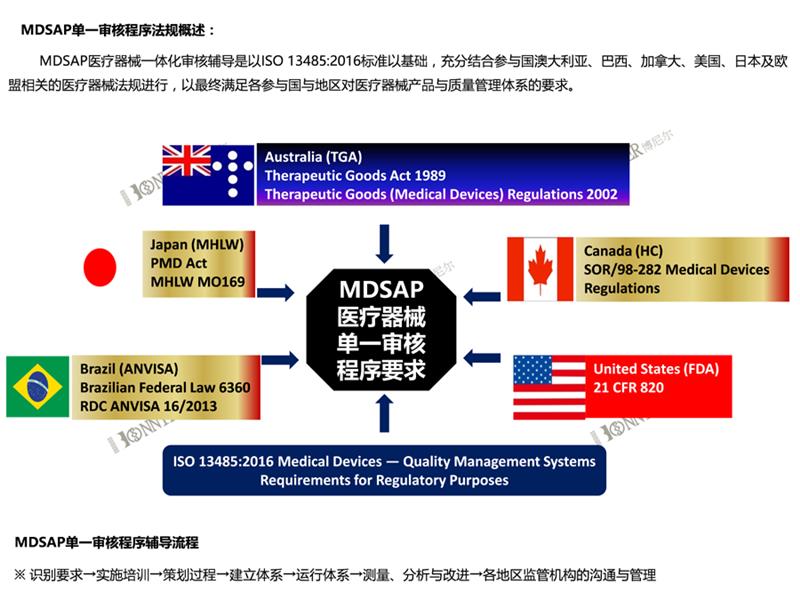
5:ISO13485咨询和认证

2017年2月Regulation (EU) 2017/745 on Medical Devices器械法规(MDR)提案发布,同年3月,欧盟成员国一致表决同意MDR。2017年5月5日,欧盟Official Journal正式对外宣MDR法规内容。MDR新法规将取代现行的有源器械指令Council Directive 90/385/EEC on Active Implantable Medical Devices (AIMDD) (1990)以及器械Council Directive 93/42/EEC on Medical Devices (MDD) (1993)指令。原计划2020年5月26日正式实施的MDR受**影响将推迟实施时间至2021年5月26日。

1.欧盟(非无菌):医用口罩、面罩、眼罩、防护服、隔离服和手套等非灭菌I类产品与检测试剂盒产品,提供技术文件、欧盟授权代表和注册凭证证办理服务。
备注:欧盟对于I类的产品,要求企业自己必须确保自己的产品符合欧盟法规,产品是*有效的,并建立相关技术文件,签署符合性声明,确定欧盟授权代表,然后到成员国主管当局注册登记之后,即可在产品加贴CE标志进入欧盟销售。
不需要公告机构参与审核发证的
SUNGO SUNGO Europe B.V.作为欧盟代表是被荷兰国家局局认可的。可以帮企业到欧盟主管注册,以免进入海关时出问题和引起法律纠纷,造成不必要的经济损失。
欢迎来到上海沙格企业管理咨询有限公司网站, 具体地址是上海金山石化松南支路48号-826座,联系人是袁小姐。
联系电话是021-68597208,联系手机是13818104617, 主要经营上海沙格企业管理有限公司SUNGO是欧盟授权代表,从事FDA验厂、欧盟自由销售证书、医疗器械单一体系审核MDSAP、CE第四版临床评价报告、MDRCE认证、CE MDR认证、CE技术文件、EU 2017/745认证、MDEL注册、MDR、CE认证等服务。。
单位注册资金单位注册资金人民币 100 万元以下。
MDR将取代现有的器械指令(93/42/EEC)(MDD)和主动植入式器械指令(90/385/EEC) (AIMDD)。MDR于2017年5月发布,标志着MDD和AIMDD之间为期三年的过渡期的开始。
在过渡期间,MDR将逐步生效,首先是与公告机构和制造商根据MDR申请新证的能力有关的规定。
过渡期将于2020年5月26日,即MDR法规的“适用日期”(DoA)结束。从那时起,MDR将完全适用。
目前急需做CE认证的客户很多,检测认证公司,代理公司也是鱼目混
杂,参差不齐。
怎么辨别口罩CE认证的真假呢?
1,凡是说3、5两千可以出CE证的都是
2,凡是说3/2天可以*的都是
3,凡是说国内公司自己可以发CE证的都是
辨别证的真伪很重要,因为一旦货到了港口清不了关损失就大了。
所以不要贪图*和快而上当受
NB号的CE证。按照现行的欧盟器械法规,此路径获取CE证的
时间至少8个月以上,费用比较昂贵。
欧盟I类器械,如果是非灭菌产品,具体分类为I类。按照指令要求,
公告机构不可强制介入I类器械的发证事宜,制造商可以基于完整的CE技
术文档宣称符合CE(自我CE符合性声明格式如下)。也即,制造商不需
要找发证机构去申请带NB号的CE证,制造商根据自己出具自我CE符
合性声即可打上CE mark,出口欧盟。在欧盟有经销活动前,需要委托
欧盟授权代表去当地主管机构做欧盟注册,整个欧盟28个成员国,只需
登记一次。整个周期是1-4周。

我司可以办理:
1:欧盟MDR CE,欧盟授权代表,欧盟注册
2:美国FDA注册,FDA510K
3:国内的器械注册证和生产许可证
4:加拿大的MDEL注册
5:ISO13485咨询和认证

2017年2月Regulation (EU) 2017/745 on Medical Devices器械法规(MDR)提案发布,同年3月,欧盟成员国一致表决同意MDR。2017年5月5日,欧盟Official Journal正式对外宣MDR法规内容。MDR新法规将取代现行的有源器械指令Council Directive 90/385/EEC on Active Implantable Medical Devices (AIMDD) (1990)以及器械Council Directive 93/42/EEC on Medical Devices (MDD) (1993)指令。原计划2020年5月26日正式实施的MDR受**影响将推迟实施时间至2021年5月26日。

1.欧盟(非无菌):医用口罩、面罩、眼罩、防护服、隔离服和手套等非灭菌I类产品与检测试剂盒产品,提供技术文件、欧盟授权代表和注册凭证证办理服务。
备注:欧盟对于I类的产品,要求企业自己必须确保自己的产品符合欧盟法规,产品是*有效的,并建立相关技术文件,签署符合性声明,确定欧盟授权代表,然后到成员国主管当局注册登记之后,即可在产品加贴CE标志进入欧盟销售。
不需要公告机构参与审核发证的
SUNGO SUNGO Europe B.V.作为欧盟代表是被荷兰国家局局认可的。可以帮企业到欧盟主管注册,以免进入海关时出问题和引起法律纠纷,造成不必要的经济损失。
欢迎来到上海沙格企业管理咨询有限公司网站, 具体地址是上海金山石化松南支路48号-826座,联系人是袁小姐。
联系电话是021-68597208,联系手机是13818104617, 主要经营上海沙格企业管理有限公司SUNGO是欧盟授权代表,从事FDA验厂、欧盟自由销售证书、医疗器械单一体系审核MDSAP、CE第四版临床评价报告、MDRCE认证、CE MDR认证、CE技术文件、EU 2017/745认证、MDEL注册、MDR、CE认证等服务。。
单位注册资金单位注册资金人民币 100 万元以下。
显示更多
产品参数
- 价格1234.00 元/个
- 数量9999.00 个
- 发货地址上海上海
- 行业咨询 管理咨询
- 查看人数90
- 信息编号208616416
- 公司编号14235332
- 相关产品
联系方式
- 公司上海沙格企业管理咨询有限公司
- 联系人袁小姐女士(经理)
- 电话021-68597208
- 手机13818104617
- 地址上海 金山 石化 松南支路48号-826座
- 商铺上海沙格企业管理咨询有限公司商铺
相关分类 更多
收起
相关地区
热门地区全部分类
最新产品














